| Du
stimulus périphérique à la
perception par le cerveau où s'élaborent différentes
réponses comportementales, le circuit de la douleur emprunte plusieurs
voies souvent redondantes. Ceci n'est pas surprenant vu l'importance
de la douleur pour l'intégrité de l'organisme. Ces multiples
voies nociceptives commencent toutes de la même façon. Le signal
douloureux en provenance par exemple de la peau voyage d'abord dans un nerf afférent
formé des fibres nerveuses des neurones
sensoriels en " T " situé dans un
ganglion spinal (ou rachidien). Les fibres qui entrent ensuite dans la moelle
épinière se divisent immédiatement et parcourent une courte
distance de un ou deux segments de la moelle épinière vers le haut
ou vers le bas. Elles forment ainsi ce qu'on appelle le faisceau de Lissauer avant
d'aboutir dans la région externe de la corne dorsale. La zone particulière
de la corne dorsale où les différentes fibres (A-alpha, bêta,
delta et C) vont faire synapse n'est pas aléatoire et correspond à
une organisation spatiale très précise. Ainsi
les fibres de gros calibre myélinisées (A-alpha pour le toucher
et A-bêta pour la proprioception) qui montent directement dans la
colonne dorsale ipsilatérale de la moelle épinière, vont
tout de même envoyer certains axones dits " collatéraux "
vers les couches profondes de la corne dorsale (voir encadré ci-bas) qui
s'étendent jusqu'à la corne ventrale. C'est là que se feront
les connexions avec les
motoneurones qui rendent possible le
réflexe de retrait. Pour ce qui est des fibres de plus petit
calibre A
delta et C qui transmettent la douleur, elles vont faire synapse sur deux
principaux types de neurones eux aussi localisés dans des couches précises
de la racine dorsale de la moelle épinière. D'une part, des
neurones nociceptifs dits " spécifiques " dont les corps
cellulaires sont situés dans les couches I et II. Ces neurones reçoivent
des fibres A-delta et C et sont donc exclusivement activés par des stimulations
nociceptives cutanées, mécaniques et/ou thermiques. Les axones de
ces neurones nociceptifs spécifiques se regrouperont pour former la
voie néospinothalamique. Et d'autre part, des neurones nociceptifs
"non spécifiques" dont les corps cellulaires sont situés
au niveau de la couche V. Ces neurones répondent de façon préférentielle
mais non exclusive aux stimulations nociceptives. On les appelle aussi neurones
" convergents ", " polymodaux " ou encore " à
large gamme de réponse " car ils peuvent être activés
autant par des fibres véhiculant des stimulations mécaniques non
nociceptives que par des stimuli douloureux de nature tactile, musculaire ou viscérale.
Ils sont également capables de coder l'intensité de la stimulation
périphérique, c'est-à-dire d'augmenter la fréquence
des influx nerveux émis en fonction de l'intensité du stimulus.
Et à partir d'un certain seuil d'activité, le message devient nociceptif.
Le champ récepteur sur la peau d'où peuvent être activés
ces neurones est plus étendu que celui des neurones spécifiques.
Il présente aussi un gradient de sensibilité : au centre de son
champ récepteur, toutes les stimulations mécaniques sont suivies
d'influx nerveux, alors qu'à la périphérie seules les stimulations
nociceptives en produisent. Les influx nerveux enregistrés dans
les neurones non spécifiques peuvent donc avoir une composante
précoce due à la mise en jeu des collatérales des fibres
A-alpha et A-bêta, puis, pour des intensités de stimulation plus
fortes, des composantes
plus tardives dues à l'activation des fibres A-delta puis C. La
convergence sur ces neurones de fibres de différents calibres d'origine
à la fois viscérale et tactile explique également deux phénomènes
particuliers : les
douleurs projetées où une douleur viscérale est ressentie
dans un territoire cutané ; et le
contrôle segmentaire de la douleur par l'activation d'afférences
non nociceptives. Les
axones des neurones nociceptifs non spécifiques formeront la voie
paléospinotha-lamique. Cette dernière a une origine
évolutive plus ancienne que la voie néospinothala-mique des
neurones spécifiques mentionnée plus haut. Et les deux sont moins
anciennes que la vieille voie archispinotha-lamique.
Mais toutes sont formées par les axones du 2e neurone principal
du circuit nociceptif menant au cerveau (le numéro 2 bleu dans le schéma
ci-contre), neurone situé dans la corne dorsale de la moelle épinière.
On parle de neurones " principaux " puisque de nombreux interneurones
situés également dans la corne dorsale modulent
la transmission de l'influx douloureux à travers ce circuit. | 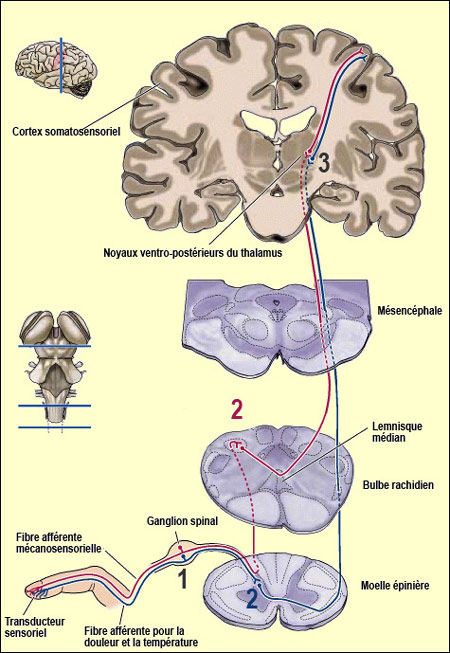
D'après
: Neurosciences, Purves, Augustine, Fitzpatrick, Katz, LaMantia, McNamara, Williams,
De Boeck Éd., 2003. |
On a donc trois grandes voies
" extralemniscales " (par opposition à la voie lemniscale, voir
plus bas) véhiculant la douleur et apparues successivement au cours de
l'évolution : la voie archispinothalamique, la voie paléospinothalamique
et la voie néospinothalamique. 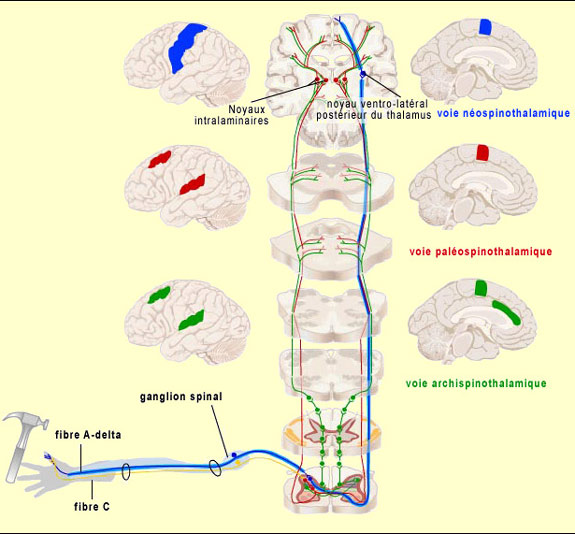
Voir
cette figure animée au http://neuroscience.uth.tmc.edu/s2/ii7-2.html
La voie archispinothalamique, le plus
ancien chemin que peuvent emprunter les stimuli douloureux pour se rendre au cerveau,
est une voie multisynaptique diffuse. Elle rejoint d'abord la région de
la
formation réticulée et de la
substance grise périaqueducale, puis les
noyaux intralaminaires du thalamus, en plus d'envoyer des collatérales
à l'hypothalamus et à différents noyaux du système
limbique, contribuant aux réactions viscérales, autonomes et
émotionnelles à la douleur.
Toujours
selon une classification phylogénétique (qui n'est pas la seule
possible, voir l'encadré), une voie dite paléospinothalamique
composée de fibres
de petit calibre à conduction lente est apparue ensuite. Cette voie,
toujours sans organisation
somatotopique, se projette largement sur la formation réticulée
à tous les niveaux du tronc cérébral, contribuant ainsi à
deux phénomènes importants. D'abord l'éveil
général du système nerveux central par le système
réticulaire ascendant. Ensuite, l'activation de certains noyaux du
tronc cérébral qui sont à l'origine des
voies descendantes du contrôle de la douleur. Les terminaisons
de la voie paléospinothalamique se poursuivent également dans les
noyaux intralaminaires du thalamus. Les neurones de ces derniers, les troisièmes
des voies nociceptives afférentes (après les neurones des ganglions
spinaux et ceux de la corne dorsale de la moelle épinière) vont
envoyer leurs projections à différentes régions corticales
dont le
cortex frontal, le cortex cingulaire et le cortex insulaire. La
voie nociceptive la plus récente d'un point de vue évolutif, n'existant
que chez les mammifères supérieurs, est la voie néospinothalamique.
C'est cette voie qu'emprunte la
composante rapide de la douleur qui nous informe de la nature du stimulus
douloureux (piqûre, brûlure, etc) et de sa localisation précise
sur notre corps. C'est aussi cette voie, habituellement appelée simplement
" spinothalamique ", qui véhicule la sensation de température. La
voie spinothalamique est formée d'axones des neurones spécifiques
de la corne ventrale de la moelle épinière qui, contrairement aux
voies archi et paléospinothalamiques, vont tous décusser, c'est-à-dire
traverser du côté controlatéral de la moelle épinière.
Les voies archi et paléospinothalamiques font en effet des connexions bilatérales
dans les structures cérébrales qu'elles innervent parce que certaines
collatérales ne décussent pas et montent directement du même
côté. Les axones de la voie spinothalamique poursuivent donc
leur chemin du côté controlatéral en montant dans la partie
antérieure et latérale de la moelle épinière, d'où
son autre nom de " cordon ventro-latéral " (certains disent aussi
" antéro-latéral "). Les axones pénètrent
ensuite dans le bulbe rachidien où ils sont rejoints par les axones du
noyau spinal du trijumeau véhiculant la sensibilité nociceptive
de la face (voir encadré) ainsi que par la voie lemniscale médiale
responsable du toucher. La plupart des fibres du faisceau néospinothalamique
issues des parties du corps situées sous le cou vont se terminer dans le
noyau ventro-latéral postérieur du thalamus. Les neurones de ce
noyau, troisième de la voie néospinothalamique, envoient quant à
eux leur axone au cortex somatosensoriel primaire.
| 