|
|

 |
 |
 |

 |
 |
Bien que la fréquence
des influx nerveux soit le phénomène par lequel
s’exprime la rythmicité des neurones du noyau
suprachiasmatique, ces influx nerveux ne sont pas nécessaires à
la génération de ce rythme. Comme une montre
à laquelle on aurait temporairement enlevé les
aiguilles, le mécanisme qui génère le
rythme endogène dans les neurones du noyau suprachiasmatique
continue à fonctionner lorsqu’on isole ses neurones
de leurs semblables dans des milieux de culture.
De plus, l’application de tétrodoxine
(TTX) sur ces neurones, en bloquant les
canaux sodiques, empêche la production de potentiels
d’action mais n’affecte aucunement le rythme
de l’activité des neurones du noyau suprachiasmatique.
D’ailleurs, lorsqu’on enlève la TTX,
les potentiels d’action reprennent avec la même
phase et la même fréquence qu’avant.
Comme les aiguilles d’une montre,
les potentiels d’action générés
par les neurones de notre horloge biologique permettent de
donner l’heure, mais pas de garder le compte du temps
qui passe. C’est au niveau moléculaire, celui
des gènes, que réside le
mécanisme ultime de cette horloge biologique. |
|
|
| LES CELLULES GANGLIONNAIRES
PHOTOSENSIBLES |
|
Une petite région de l’hypothalamus, le
noyau suprachiasmatique, est reconnue comme étant
l’horloge centrale qui coordonne les fluctuations cycliques
de plusieurs fonctions du corps humain (sommeil,
sécrétion cyclique d’hormones, etc).
La fréquence de décharge des cellules du noyau suprachiasmatique
varie ainsi selon un cycle régulier de 24 heures.
Cette activité rythmique n’est pas le
fruit de la connectivité de ses neurones mais bien de boucles
de rétroaction à l’intérieur même
de chacune des cellules.
On en est arrivé à cette conclusion après
avoir prélevé des neurones du noyau suprachiasmatique
chez le rat et les avoir isolés en milieu de culture in
vitro. Ne faisant ainsi aucune connexion avec d’autres neurones,
on a constaté que chaque neurone pris individuellement continuait à faire
varier son activité selon un cycle d’environ 24 heures
(voir encadré à gauche).
Mais contrairement à ce qui se produit dans le cerveau,
les cellules du noyau suprachiasmatique en culture ne synchronisent
pas leur activité cyclique avec celle du jour et de la nuit.
Or notre horloge biologique, comme n’importe quelle horloge,
a besoin d'être réajustée périodiquement.
Chaque cellule de cette horloge doit donc se resynchroniser quotidiennement
avec des indices externes lui indiquant le début ou la fin
de la journée. Parmi ces synchronisateurs externes, aussi
appelés Zeitgeber (« donneur de temps »,
en allemand), on connaît la température ambiante,
la prise des repas, le bruit ou le degré d’activité
de l’organisme. Mais le plus puissant est certainement l’intensité lumineuse
générale.
Il doit donc y avoir une voie nerveuse qui part de la
rétine de l’œil et qui transmet les variations
d’intensité lumineuse aux cellules de l’horloge
biologique du noyau suprachiasmatique. Car contrairement aux
cellules en culture coupées de ces connexions nerveuses
en provenance de la rétine, les cellules localisées
dans le noyau suprachiasmatique peuvent recevoir cette information
par l’entremise du nerf optique.
Les cellules de la rétine responsables de cette détection
de l’intensité lumineuse ne sont ni
les cônes, ni les bâtonnets, mais bien certaines
cellules ganglionnaires aux propriétés singulières disséminées
parmi l’ensemble des cellules ganglionnaires.
Nombre d’expériences ont permis de vérifier
cette hypothèse. On sait par exemple que des personnes aveugles
conservent un rythme biologique normal. Par contre, des atteintes
cérébrales qui détruisent complètement
les nerfs optiques empêchent à
la fois la vision et la régulation du rythme circadien.
Des souris dont la couche de photorécepteurs est complètement
dégénérée conservent également
leur rythme circadien. Tout porte donc à croire que ce sont
bien des cellules ganglionnaires qui constituent le premier maillon
de ce système photosensible non visuel.
Ensuite, différentes techniques de marquage ont permis de
constater que cette sous-population particulière de cellules
ganglionnaires envoie effectivement des axones directement
aux dendrites des neurones des noyaux suprachiasmatiques (voir
encadré ci-bas).
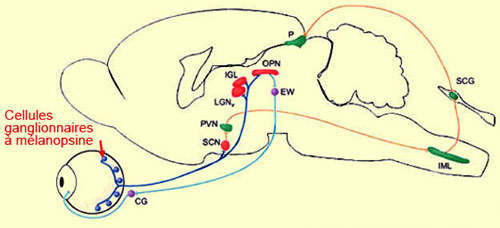
Source : Ralph Nelson, http://webvision.med.utah.edu
Ce système non-visuel de détection de l’intensité
lumineuse serait également impliqué dans le contrôle
du réflexe pupillaire, le processus par lequel notre pupille se
dilate quand il manque de lumière ou se contracte quand
il y en a trop. Certains axones de la voie rétinohypothalamique
poursuivraient donc leur chemin au-delà de l’hypothalamus
vers d’autres noyaux cérébraux impliqués
dans le réflexe pupillaire, comme le corps géniculé
latéral, le noyau olivaire prétectal et le noyau
Edinger Westphal (respectivement LGN, OPN et EW sur le schéma
ci-haut).
Pour identifier les
cibles des axones des cellules ganglionnaires impliquées
dans la détection de l’intensité
lumineuse, les scientifiques ont eu recours à
des souris “knock in”. Contrairement aux souris “knock
out” où l’on inactive un gène particulier,
les souris utilisées ici avaient un gène qui
leur avait été
ajouté. Leurs cellules ganglionnaires contenant de la
mélanopsine possédaient en plus le gène
tau-lac Z qui produit une protéine pouvant être
colorée sélectivement. Et comme cette protéine
peut en plus voyager le long de l’axone, elle révèle
ainsi sa trajectoire et ses différentes destinations.
Ces expériences permirent de constater que le noyau
suprachiasmatique était très densément
innervé par les axones des cellules ganglionnaires produisant
de la mélanopsine. Mais plusieurs autres régions
du cerveau reçoivent également des connexions
de ces cellules, en particulier des noyaux impliqués
dans le réflexe pupillaire (comme le montre l’image
ci-haut)
|
|
|