|
|
| Le financement de ce site est assuré par vos dons, merci! | |
|
|
|
|
|||||
|
|
|||||||
|
|
|
|
|
|
Richesse et complexité structurale du neurone À la recherche de la trace du temps perdu dans nos synapses Nouveau cas unique d’amnésie déclenché après une visite chez le dentiste ! « La cognition incarnée », séance 4 : Plasticité et mémoires : l’inévitable hippocampe L’engramme mnésique, ou la trace concrète d’un souvenir dans notre cerveau Les multiples niveaux d’organisation du vivant, plus que jamais au cœur des sciences cognitives Bref survol de dix ans de neurosciences cognitives
|
|
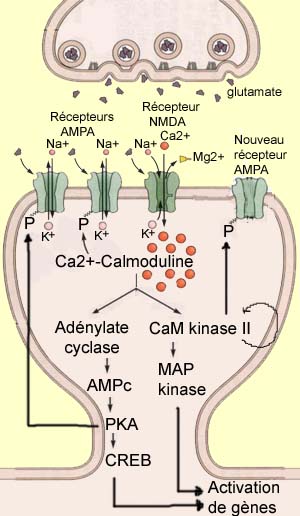
La potentialisation à long terme (ou PLT) est un processus de renforcement synaptique très étudié pour son rôle probable derrière plusieurs types de mémoire. À l'inverse de la LTD, il correspond à une augmentation d'amplitude de la réponse post-synaptique à la suite d'une intense activation pré-synaptique. Celle-ci est généralement courte (< 1 seconde) mais de fréquence élevée (> 100 Hz). Ce type de stimulation provoque une dépolarisation post-synaptique suffisante pour évacuer les ions magnésium qui bloquent le récepteur NMDA et permettre ainsi l'entrée massive de calcium dans le dendrite. Or, l'ion calcium est un messager intracellulaire extrêmement important qui active un grand nombre d'enzymes en modifiant leur conformation. C'est le cas de la calmoduline qui devient active lorsque quatre ions calcium s'y fixent. Elle devient alors la Ca2+-calmoduline, second messager principal de la PLT capable d'activer à son tour d'autres enzymes qui jouent un rôle clé dans ce processus comme l'adenylate cyclase et la protéine kinase II calmoduline-dépendante (CaM kinasse II). Ces enzymes vont à leur tour modifier la conformation spatiale d'autres molécules, le plus souvent en leur ajoutant un ion phosphate, un processus catalytique fréquent appelé phosphorylation.
Pour donner une idée de la complexité des chaînes métaboliques responsables de la PLT, mentionnons quelques autres enzymes actuellement à l'étude. D'abord la protéine kinase C (ou PKC) qui phosphorylerait les récepteurs AMPA au même endroit que la CaM kinasse II ; l'Inhibiteur 1 (ou I1) qui serait activé par la PKA et empêcherait la phosphatase 1 de déphosphoryler les récepteurs AMPA ; et la tyrosine kinase SRC qui pourrait être activée directement par les récepteurs AMPA et phosphoryler alors les récepteurs NMDA.
En plus de tous les mécanismes post-synaptiques qui déclenchent l'établissement de la PLT, on a depuis longtemps postulé des modifications pré-synaptiques lors de la phase de maintien de la PLT qui survient après son établissement. Mais des modifications comme l'augmentation de glutamate relâché, par exemple, impliquerait la présence d'un messager rétrograde qui reviendrait vers la cellule pré-synaptique pour la modifier. À cause de sa nature gazeuse qui lui permet de diffuser à travers les membranes cellulaire, l'oxyde nitrique (ou NO) serait un candidat de choix pour jouer ce rôle. Mais son implication est encore grandement débattue et demeure controversée.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|
|
|
|
|
|
|
|