|
|
| Le financement de ce site est assuré par vos dons, merci! | |
|
|
|
|
|||||
|
|
|||||||
|
|
|
|
| |
es oligomères pour maintenir la trace de nos souvenirs Dormir pour nettoyer et réinitialiser le cerveau De l’importance des oscillations cérébrales lentes durant le sommeil profond Ce qui est bon pour le cerveau en 6 points dont 3 encore confirmés |
|
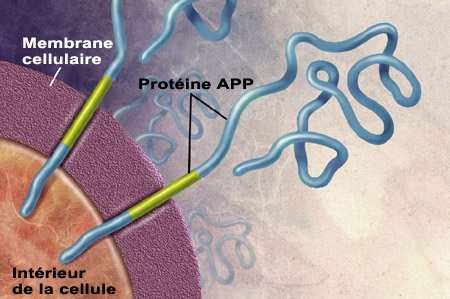
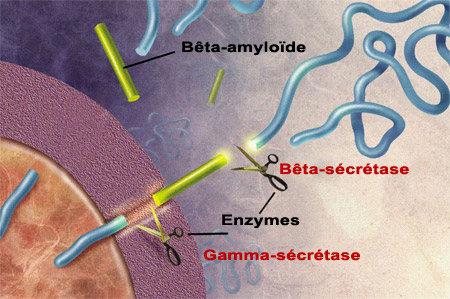
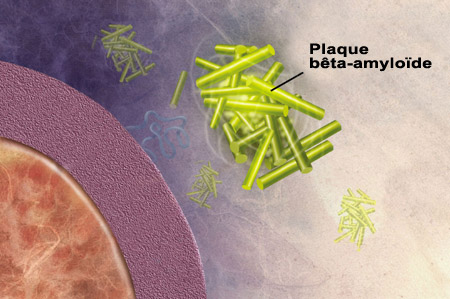
Selon l’hypothèse amyloïde, les plaques amyloïdes qui se forment avec l’âge entre les neurones seraient toxiques et, par conséquent, à l’origine des pertes cognitives associées à l’Alzheimer. Bien que cette hypothèse est loin d’avoir livré tous les secrets de l’Alzheimer, de grands efforts de recherche ont été consacrés à la compréhension des mécanismes de formation de ces plaques. Mais d’abord, d’où vient cette épithète d’amyloïde ? Il faut remonter à la fin du XIXe siècle pour en saisir le sens. À l’époque, le médecin allemand Rudolf Virchow étudiait une maladie dans laquelle certains organes, tels le coeur, la rate, le foie et la langue, grossissaient et durcissaient. Pour tenter d’identifier la substance responsable de ce dysfonctionnement, Virchow fit réagir ces tissus à une solution de lugol (à base d'iode) qui en modifia la couleur. Et selon les connaissances de l'époque, ce changement de couleur trahissait la présence de glycogène ou d'amidon, c’est-à-dire des chaînes de sucres. Virchow qualifia donc « d’amyloïde » cette substance imprégnant ses tissus qu’il croyait proche de l’amidon (du grec amylo pour amidon, et –ïde pour« semblable à »). En fait, Virchow avait coloré non pas un sucre, mais une protéine, comme on le démontra quelques années plus tard. D’autres colorants, comme le rouge Congo ou la thioflavine, se liaient également à ce matériel protéique amyloïde. C’est en 1927 que le psychiatre belge Paul Divry constate que le rouge Congo colore aussi les « plaques séniles » déjà décrites par Alois Alzheimer lui-même deux décennies auparavant. Pendant plusieurs autres décennies, on tenta en vain de déterminer quelle était la protéine qui formait le cœur de ce qu’on appelait maintenant les plaques amyloïdes. Il fallut attendre jusqu’en 1984 pour que l'Américain George Glenner et ses collègues caractérisent la structure de ces protéines qui s’agglutinent pour former les plaques amyloïdes. Mais ce n’est pas dans la structure linéaire de la protéine, autrement dit dans la séquence d’acides aminés qui la compose, que Glenner découvrit pourquoi cette protéine était « amyloïde ». Il comprit que c’était plutôt par sa structure secondaire, c’est-à-dire son organisation dans l'espace, et non sa séquence d'acides aminés, qu’elle acquérait cette propriété. Certaines protéines, ou certains peptides (qui sont de courtes protéines), se replient en effet dans l'espace en structures particulières qu’on appelle les feuillets bêta plissés. Et c'est la richesse en feuillets bêta plissés qui est responsable de leur affinité pour le rouge Congo et la thioflavine, bref de son caractère amyloïde. Ce sont également ces feuillets bêta qui confèrent à la bêta-amyloïde son aspect compact, stable et insoluble. Comme le peptide identifié par Glenner n'avait jusque-là jamais été décrit, on le nomma peptide A bêta (A pour amyloïde, et bêta pour les feuillets bêta plissés). On sait aujourd’hui que le peptide A bêta, aussi couramment appelé bêta-amyloïde, provient du clivage d’une autre protéine plus grosse nommée APP (« Amyloid Protein Precursor », précurseur de la protéine amyloïde, en anglais).
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
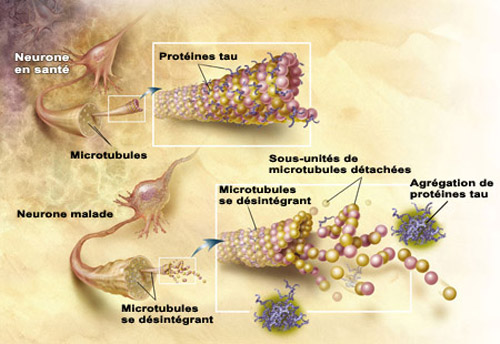
Dans les années 1980, on n’était pas certain de la nature des dégénérescences neurofibrillaires, très présentes dans les neurones des patients Alzheimer. L’hypothèse dominante voulait qu’elles soient constituées d’éléments du cytosquelette. En 1985, Jean-Pierre Brion trouve un anticorps qui marque de façon sélective les dégénérescences neurofibrillaires de cerveaux Alzheimer non pas en s’attachant directement avec des protéines du cytosquelette qui donnent leur forme aux neurones, mais bien avec la protéine tau (pour « tubulin associated unit », en anglais) qui stabilise ce cytosquelette. D’autres équipes confirmèrent par la suite que la protéine tau est l’élément principal des dégénérescences neurofibrillaires. Comme les peptides bêta-amyloïdes, les protéines tau sont des molécules normales de l'organisme qui deviennent problématique quand des transformations moléculaires augmentent leur propension à s’agglutiner entre elles. Ce faisant, elles ne peuvent plus maintenir en place les microtubules, ces « rails » qui assurent le transport de nutriments dans les neurones, et compromettent la survie de ceux-ci.
Il y a plusieurs suspects à l’origine des transformations possibles pouvant rendre les protéines tau plus « collantes » entre elles : des mutations du gène tau, des modifications dans l’expression de ce gène, des anomalies durant les étapes qui mènent à la production de la protéine tau, etc. Le suspect numéro un serait toutefois une trop grande phosphorylation de la protéine tau. Cette protéine peut en effet recevoir plusieurs groupements phosphates à différents endroits de sa chaîne moléculaire. Et c’est lorsque beaucoup de ces sites sont phosphorylés que les protéines tau se détacheraient des microtubules pour s’agglutiner entre elles. Ce processus, qui aboutit à la formation de dégénérescences neurofibrillaires, n’est toutefois pas spécifique à l’Alzheimer. On le retrouve dans près d’une vingtaine d’autres démences et maladies neurodégénératives. C’est le cas par exemple de la dégénérescence fronto-temporale, de la maladie de Pick et de nombreux syndromes parkinsoniens. Les causes du dysfonctionnement de la protéine tau peuvent varier pour chacune d’elles, mais ces altérations provoquent toujours des dégénérescences neurofibrillaires qui vont finir par altérer les fonctions cognitives. D’où le concept de pathologie tau ou
« tauopathies » pour décrire l’ensemble de
ces phénomènes qui résultent tous d’un dysfonctionnement
direct ou indirect des protéines tau. Et l’on croit que passé
75 ans, cette pathologie tau apparaît même dans le cerveau humain
normal (mais voir l’encadré à gauche), surtout dans la
région entorhinale, puis hippocampique, deux régions très
impliquées dans la
mémoire à long terme. |
| |
|
|
|
|
|
|
|
|